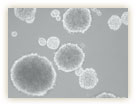
生物の再生といえば誰もがイモリを思い浮かべるのではないだろうか。イモリは尻尾や肢だけでなく、眼のレンズも再生できることは古くから知られている。19世紀の終わりに、ドイツのウォルフ博士は、レンズが取り除かれると、レンズの上部にある虹彩(黒目)の細胞が変化してレンズを再形成することを見出した(図1)。その後長い時を経て、日本の江口吾郎博士が、培養した1つの黒目細胞がレンズ細胞に転換することを証明し、この“細胞の転職”とも言える現象を「分化転換」と名付けた。
ヒトの眼も、イモリのように再生できないものか。一世紀以上も研究されてきたこのテーマに、体性組織幹細胞研究ユニットの小阪美津子博士は一つの答えを出しつつある。小阪博士が眼の再生をターゲットに研究を始めたのは1993年。まず、鳥類の黒目細胞を取り出して培養系を確立するところから始まった。

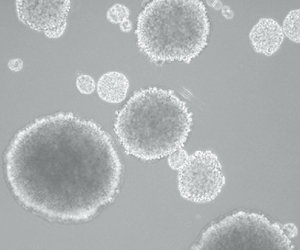
イモリの黒目細胞は生体内で可塑性を発揮し、眼のレンズを再生するが、鳥類のレンズはいったん傷つくと自然には再生しない。しかし小阪博士は、培養された鳥の黒目細胞に、ある生体内因子を添加すると、レンズへと分化転換することを発見した(図2)。
さらに、鳥と同じく自然には決してレンズを再生しない哺乳類の黒目細胞で分化転換にチャレンジ。ラットの黒目細胞に、視細胞の発生や維持に重要な役割をもつ遺伝子を導入し、網膜視細胞へと分化転換させた。これは、京都大学眼科グループらと共に研究を行ったもので、2001年に論文発表され、社会的にも大きな反響を呼んだ。
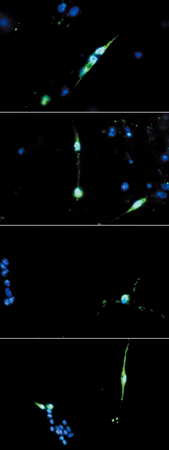
そして、マウスの黒目細胞を採取培養し、遺伝子導入を介さなくても適切な環境を整えてやれば、レンズや網膜神経細胞へと分化させられることも初めて、明らかにしたのだ(図3)。
イモリや鳥類ではなく哺乳類で、黒目細胞から網膜神経細胞へと分化転換できたことは、再生医療の実現を予見させる画期的な成果だ。人工レンズ(水晶体)や他人の角膜を移植する手術は、既に行われている。しかし、中枢神経の一部である網膜は、障害を受けると再生することはなく、移植手術も試験的には行われたことがあるものの効果ははかばかしくない。しかし、ヒトでも黒目細胞から網膜細胞への転換が可能になれば、患者自身の黒目細胞を少し採取し、網膜細胞にして移植することができる。患者自身の細胞由来の網膜細胞なので、拒絶反応もなく定着する可能性が高い。また、黒目はまぶたに隠れた部分がかなりあるので、黒目細胞をその隠れた部分から採取すれば、患者の日常生活に与える影響は小さい。小阪博士は、サルの黒目細胞やヒトの黒目細胞も培養し、臨床試験のための材料提供に向けて研究を続けている。

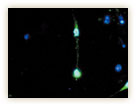

一方で、小阪博士の関心は臨床応用に留まらず、幹細胞の機構解明へも向かっている。「幹細胞研究につながるなどとは、当初は思いも寄らなかった」、小阪博士は、この研究に着手した10年前のことをこう振り返る。
実は、黒目細胞の研究はもともと次善の策だったという。「当時は新しい研究室に移ったばかり。前任者から別の細胞の培養系を引き継いで研究を進めようとしたけれど、どうもコンディションが良くなかった」。そこで、レンズ再生現象の源である黒目細胞に立ち返って研究することを思い立ち、ニワトリから新たに採取した黒目細胞をつかって新しい実験系を確立しようとしたのだ。「とてもうまくいきました。条件を整えると、黒い細胞がのびやかに増えだし、美しい透明なレンズになるのです。条件を元に戻すと、再び黒い細胞にきれいに戻る。惹き付けられました」。
美しさに見とれ、この黒目細胞の系ならばなにかが分かる、と信じた。小阪博士は何年もかけてヒヨコやマウスの黒目細胞を採取培養し、細胞の状態を試験管内で制御する研究を続けた。
そして、臨床応用へと可能性を開く網膜神経細胞の分化誘導に成功すると共に、極めて重要なことに気がついた。「均一に見える黒目細胞の一部は、もしかすると幹細胞かもしれない」。黒目細胞を分化転換させる培養条件が、当時研究が一気に加速した神経幹細胞の培養法と極めて似通っていることに気付いたのだ。1999年のことだった。そこから小阪博士の幹細胞を巡る研究は、一気に加速した。
鳥類や哺乳類の黒目細胞を単離し、ある方法で培養すると、幹細胞に特徴的な細胞塊を形成し、実際にこれらの細胞は幹細胞に特徴的な遺伝子を発現していた(図4)。さらに、虹彩上皮を形成する黒目細胞が均一ではないことも突き止めた。一部の細胞しか塊を形成しないのだ。生体内の黒目組織の中でも、一部の細胞だけが幹細胞の性質を保持して存在するらしい、ということが明らかになった(図5)。
これらの結果は、これまでの眼の分化転換の概念を大きく変えるものになりうる。従来、黒目細胞がレンズや網膜神経細胞に変わるのは、黒目細胞が幹細胞に脱分化し、幹細胞がレンズや網膜神経細胞に再分化するためだ、と考えられてきた。
しかし、小阪博士の提唱する概念は違う。黒目細胞の一部は幹細胞の性質を備えており、それがレンズや網膜神経細胞へと分化するのではないか。小阪博士は、そう考えている。
通常、生体内では幹細胞の性質を留めた黒目細胞はほんのいくつか、ひっそりと存在していて、活動を静止させたまま終わる。イモリでは、眼に障害が起きると、黒目組織中の幹細胞が刺激を受け、眼を再生する。だが、鳥類や哺乳類では培養系という人工条件下でのみ、幹細胞としての機能を発揮する。
小阪博士は、長年黒目細胞を扱ってきた経験と知識、テクニックの見事さで、黒目細胞研究に関しては他の研究者の追随を許さない。その利点を存分に活かし、この幹細胞の単離を目指している。どうも、予想以上のポテンシャルをもっており、眼だけでなくもっと幅広い分化能、思い切って言えばES細胞のような多能性とも言えるような力を持つのではないか。小阪博士はそう考えている(図6)。
自分自身の体のなかにある体性幹細胞の性質を理解し、その能力を引き出すことができれば、ES細胞にたよらない理想的な再生医療の実現につながるかもしれない。この研究は、大きな可能性を持っている。
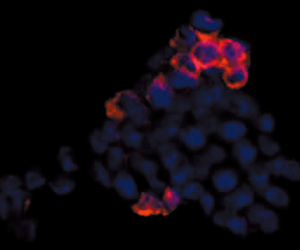
一方、中枢神経系での分化転換の研究に挑んでいるのは、その名も分化転換研究チームの近藤亨博士だ。
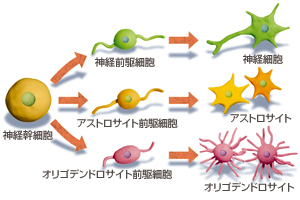
中枢神経系の中には神経細胞とその10倍ほどの数のグリア細胞がある。神経細胞がシナプスを介して電気信号を伝達する一方で、グリア細胞の一種、アストロサイトはシナプス機能の調節を行い、別のグリア細胞であるオリゴデンドロサイトは、神経細胞の軸索を包み込み、絶縁体として機能している。
中枢神経系にも、これらの神経細胞やグリア細胞への分化能をもつ神経幹細胞が存在することは、最近の研究で分かっていた(図7)。神経幹細胞を豊富に得られれば、脳障害などの疾患の治療に役立てられるだろう。だが、生体内の神経幹細胞は極めて微量であり、また明確に同定されたものでもない。そのため、現実には神経幹細胞を用いた中枢神経系の再生医療実現は、まだ遠い。
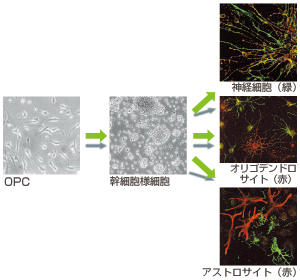
近藤博士は、ロンドン大学に留学していた1998年から、培養したマウスのオリゴデンドロサイト前駆細胞(OPC)を神経幹細胞に「脱分化」させるという、いわば生体内のカスケードを逆戻りさせることを試みた。
そして1999年、近藤博士の試みは実を結んだ。いくつかの生体内因子を加えて培養条件を整えると、OPCが神経幹細胞と同様の多分化能を獲得することを見出したのだ。OPCならば、脳内に豊富にある。神経幹細胞をつかまえられなくとも、OPCを幹細胞様細胞に誘導できれば、中枢神経の疾患を抱える患者の治療に活かすことができるかもしれない。
OPCを選んだのは、中枢神経の中でもっとも研究が進み、特徴が良く分かっていたからだ。98%以上の純度で精製が可能で、その上培養方法が確立されていた。当時、近藤博士は担当教授から「だれも答えていない実験を」と指導され、分化転換の研究に挑み、OPC由来の幹細胞様細胞が試験管内でオリゴデンドロサイトだけでなく、神経細胞やアストロサイトにも分化することを発見する(図8)。
近藤博士は、ケンブリッジ大学へ移った後もOPC脱分化の分子機構の研究を進め、OPCが多分化能を獲得する過程で、染色体の構造に変化がおこり、神経幹細胞と同様の遺伝子発現を獲得することも明らかにした。
近藤博士は「このような脱分化の分子機構を解明できれば、特定の物質を与えるだけで、OPCを幹細胞化できる、細胞運命を変えられるかもしれない。とすれば、新しい再生医療における研究の意義は大きい」と語る。

近藤博士はさらに、別の側面からも神経幹細胞の研究を始めた。通常、生体内ではOPCから幹細胞様細胞へと逆行するような脱分化は起きない。しかし、一つだけ可能性がある。それは、がん化だ。
悪性腫瘍中に、幼若で未分化な細胞、いわば幹細胞様がん細胞(がん幹細胞)が存在することは従来から示唆されていた。OPCが脱分化し、幹細胞を経由してがんになる、あるいはがん化すると同時に脱分化する、というような流れが、生体内で起きているのではないか?
その「流れ」を突き止められれば、がん研究は大きく進展する。「ならばまず、がんの中に本当にがん幹細胞が存在するのかどうか突き止めよう」と近藤博士は考えた。
近藤博士は試行錯誤の末、ラットのグリオーマ(悪性脳腫瘍の一種)細胞やヒトグリオーマ細胞、ヒト乳がん細胞などで、幹細胞の特徴をもつがん幹細胞を見出しており、現在ではそれらの分離にも成功している(図9)。
がんの再発にがん幹細胞が関わっている、と近藤博士はみる。がん幹細胞の特徴をみると、どうも抗がん剤を外に排出してしまう機能があり、抗がん剤に耐性をもつのではないか、というのだ。幹細胞は分裂のスピードが非常に遅いため放射線治療にも耐性であると考えられる。つまり、現在の治療法ではがん幹細胞を殺傷できていない可能性がある(図10)。がん幹細胞の詳しい解析が進み、ターゲットとする治療法を見出せれば、ガンの根治が可能かもしれない。
こうした研究を通じて近藤博士が抱いているのは、中枢神経系のなかに遷移状態の細胞があるという新しいイメージだ。中枢神経系のなかには、ごく少数の幹細胞、機能細胞へ分化する前駆細胞、そして最終分化した神経細胞やグリア細胞が存在するが、「完全に分化しきっていない前駆細胞とある種のグリア細胞は遷移状態を保ち、刺激により増殖し始める。もしこれらの細胞が変異するとがんになる可能性がある。また、遷移状態の細胞を取り出し条件を整えてやると幹細胞に脱分化する」と考える。その微妙でしなやかな細胞の振る舞いが、どのような仕組みにより保たれているのか。近藤博士の研究は中枢神経系の神秘に分け入ろうとしている。
近藤博士と小阪博士の分化転換をめぐる研究は、細胞運命は絶対的なものではなく、一度分化した細胞でも環境によっては大きく姿を変える可能性や、今まで均一と思われた生体内の「年老いた」細胞集団のなかにも「若さ」を保った幹細胞が存在する可能性を示した。二人の研究は、新しい細胞像、素晴らしい潜在力を今後も私たちに見せてくれるに違いない。