 |
|||||||
| 研究内容 多くの多細胞生物は、発生過程において器官や体の大きさが遺伝学的に決められています。その一方で、細胞の増殖や組織の形成は、温度や栄養源という外部環境により影響を受けます。各組織の大きさは何らかのメカニズムで認識され、組織自身の増殖が制御され、また発生過程におけるタイミングとして個体に反映されます。一方で、発生過程のタイミングによっても、個々の細胞増殖や組織形成は正または負に制御されます。つまり、一定の姿形を持つ動物の発生は、外界シグナルに対する感知システムと、それに対する細胞間シグナル伝達により、柔軟に適応できるようになっています。私たちは、ショウジョウバエおよび培養細胞を用いて、以下の二点について解析しています。 1)どのようなメカニズムで、発生過程のタイミングが細胞増殖を制御しうるのか。 2)栄養源がどのようなメカニズムで認識され、細胞増殖や組織形成に反映されているのか。 生化学および遺伝学的なアプローチを用い、代謝制御による成長と発生タイミングの制御機構について解析します。組織もしくは個体レベルで、栄養源認識システムと細胞間シグナルの実体について、統合的な理解を目指しています。 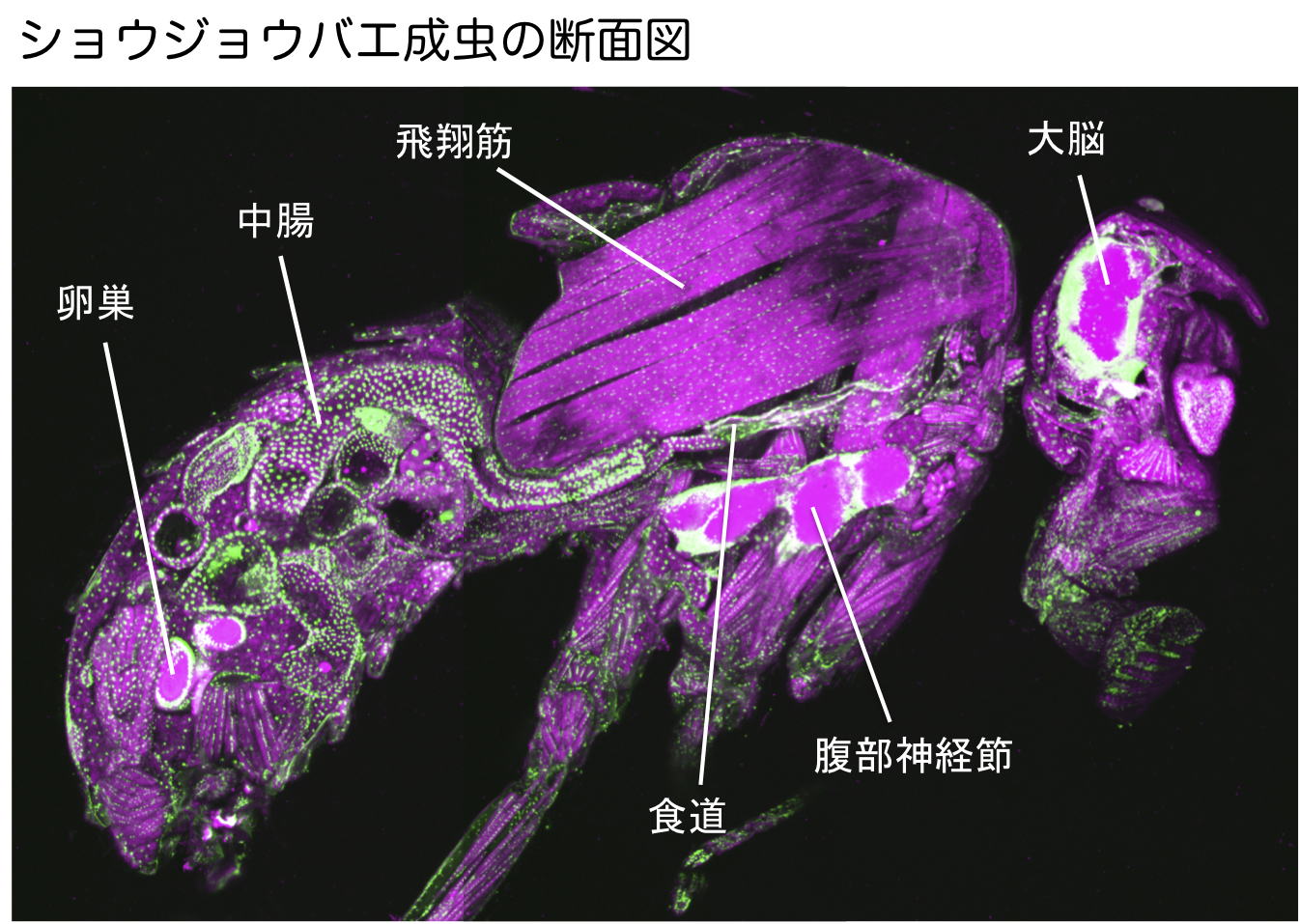 ショウジョウバエの発生過程 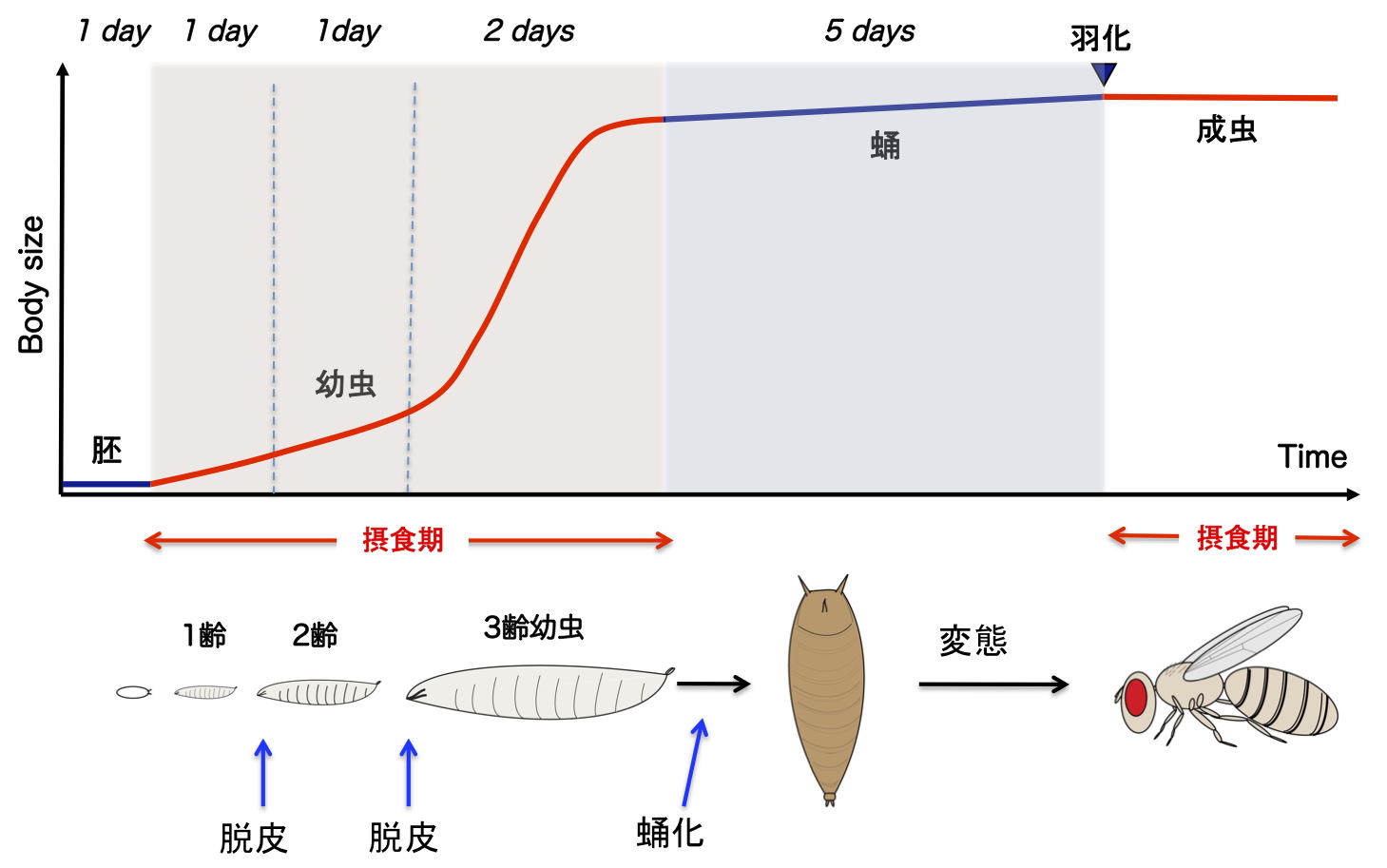 現在の主要な研究テーマ インスリン族ペプチドは、ヒトを含む脊椎動物ばかりでなく昆虫を始めとする無脊椎動物にも広く存在しており、それらは代謝、成長、生殖、寿命など多岐にわたる生命現象を制御している内分泌ホルモンである。ショウジョウバエでは7種類のインスリン様ペプチドをコードする遺伝子(Drosophila insulin-like peptides; Dilps)がゲノム中に存在する。Dilps は主にインスリン産生細胞(insulin-produing cells; IPCs)と呼ばれる脳間部の神経分泌細胞で産生され、体液中に分泌される。Dilps の発現分泌は摂食に伴う栄養源により調節されており、栄養依存的に末梢組織の成長を促進する。よって、成長促進作用のあるインスリン様ペプチドもしくはインスリン様受容体の欠損個体では、栄養を摂取しているにも関わらず成長が遅延し体サイズが小さくなる。  (上図)個体成長に異常をきたすショウジョウバエ変異体 脳インスリン産生細胞(IPCs)除去個体とインスリン様受容体(DInR)変異体を示す。 dilp遺伝子の発現は、成長や代謝に大きな役割を果たすだけに厳密に制御される必要があるが、その仕組みはまだ良くわかっていない。dilp遺伝子の中でも、幼虫期に発現が上昇し、栄養依存的に発現が制御されているdilp5遺伝子に着目し、その転写調節機構を探索した。インスリン産生細胞特異的なRNAiスクリーニングにより、Dachshund (Dac) と Eyeless (Ey) の2種類の転写因子が、dilp5遺伝子の発現を制御していることを明らかにした。DacとEyは複合体を形成し、dilp5遺伝子のプロモーター領域に直接結合し、協調的に発現調節していることが明らかになった。また、哺乳類のインスリン遺伝子の発現においても、Dach1/2とPax6(Ey)が同様に協調的な働きをしている可能性を示した。 Okamoto N, Nishimori Y, Nishimura T. Conserved role for the Dachshund protein with Drosophila Pax6 homolog Eyeless in insulin expression. PNAS. (2012) 109 : 2406-2411. (Pubmed) 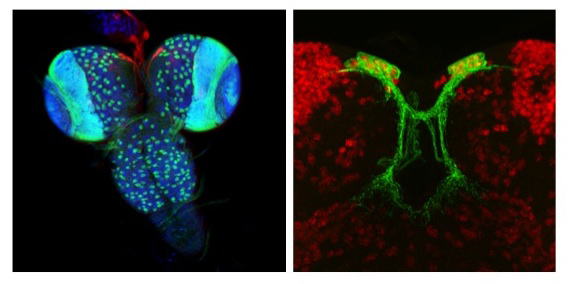 (左)ショウジョウバエ幼虫の大脳組織。 神経幹細胞を緑色、インスリン産生細胞(IPCs)を赤色で示す。 (右)脳インスリン産生細胞(緑)で発現している転写因子Dac(赤) 現在、dilp5遺伝子がどのようなメカニズムで、栄養依存的な発現調節を受けているか、また栄養源を認識している組織や細胞は何か、細胞間のシグナル伝達を含めた分子機構を解析している。 インスリン様ペプチドは血中に分泌された後、細胞膜上のインスリン様受容体を介して体及び組織の成長を制御する。しかしながら、血中に分泌されたインスリン様ペプチドの機能を調節するメカニズムに関しては不明な点が多く残されている。 ショウジョウバエゲノム中に存在する分泌性因子をコードする遺伝子を対象としてRNAiスクリーニングを行った結果、CG3837遺伝子(後に、SDR[Secreted Decoy of InR;分泌型おとりインスリン様受容体]と命名)の機能低下により体サイズが顕著に大きくなることを見出した。 SDRは、インスリン様受容体の構造に非常に良く似ているが、細胞膜貫通領域及び細胞内領域を持たないタンパク質である。SDRは脳神経系のグリア細胞から血中に分泌される分泌性タンパク質であり、インスリン様ペプチドと結合することが明らかになった。SDR遺伝子の欠失により体の成長速度が顕著に増加し、結果的に体サイズが大きくなる。逆に、SDRの過剰発現個体は、体サイズが顕著に小さくなった。これらの結果は、SDRが体の成長を負に制御する因子であることを示している。 末梢組織におけるインスリン様受容体の下流シグナル伝達経路(インスリンシグナル伝達経路)の活性を解析したところ、SDR機能欠損により活性化し、過剰発現により低下していることが明らかになった。これらの結果から、SDRは血中に分泌され、“おとり受容体”として血中のインスリン様ペプチドに直接結合し、細胞膜上の正規の受容体への結合を阻害することにより、体の成長を負に制御していることが示された。 ショウジョウバエの幼虫は、摂食に伴い栄養依存的に急激に成長し、幼虫期に溜め込んだ栄養を蛹期に使用して成虫に変態する。SDR機能欠損個体の幼虫を通常の餌で飼育した場合、体サイズが大きくなる以外に特に顕著な表現型は見られない。しかしながら、栄養の枯渇した培地で飼育すると、体サイズが大きくなるとともに、蛹期における致死率が顕著に上昇した。これは、SDR遺伝子の欠失により、栄養枯渇状態にも関わらず成長が促進され、栄養を貯蔵できなかったためだと考えられる。つまり、SDRは、栄養状態の変化に対して成長と栄養貯蔵のバランスを保つのに必要な因子であると考えられる。 Okamoto N, Nakamori R, Murai T, Yamauchi Y, Masuda A, Nishimura T. A secreted decoy of InR antagonizes insulin/IGF signaling to restrict body growth in Drosophial. Genes Dev. (2013). 27 : 87-97. (Pubmed) 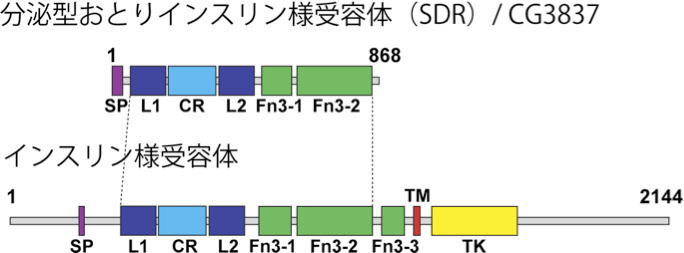 図1) SDRとインスリン様受容体の構造 SDRには細胞膜貫通領域(TM)と細胞内チロシンリン酸基転移酵素領域(TK)は存在しないが、細胞外領域の構造はインスリン様受容体と非常に良く似ている。 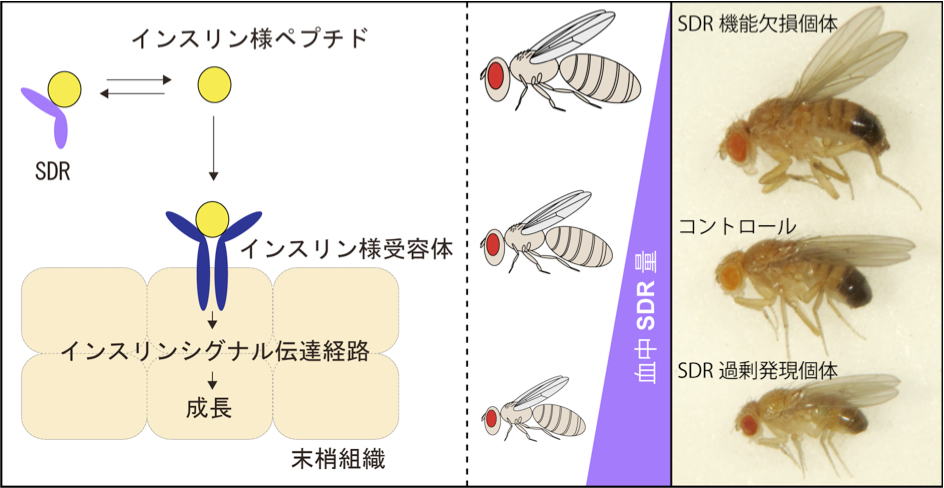 図2) SDRの作用機序の模式図とSDR変異体の表現型 SDRは血中でインスリン様ペプチドに直接結合し、細胞膜上のインスリン様受容体への結合を阻害することにより、体の成長を抑制する。血中SDR量に応じて体の大きさが変化する。実際に、SDR欠損個体では体が大きくなり、SDR過剰発現個体では体が小さくなる。 現在、SDRが体サイズの制御以外に、糖や脂質などの代謝調節や寿命にも関与しているかどうか、またグリア細胞で発現する生理的な意義は何か、解析している。 |
|||||||
| Home Research Member Publication Activities Lab photo Recruit Contact | |||||||
|
Copyright (C) 2012 Laboratory for Growth Control Signaling, RIKEN CDB. All Rights Reserved. |
|||||||