
CDBからのニュース、お知らせを掲載しています。
網膜は複雑な層構造を持つが、そのうち視細胞層は光を受容する重要な役割を果たす。この視細胞が変性して失われてしまう病気に網膜色素変性がある。網膜色素変性になると、夜盲や視野の狭窄、視力の低下などの症状を引き起こす。現在のところ、遺伝子治療や人工網膜の研究が行なわれているものの、有効な治療法は確立していない。近年、理研CDBの永楽元次チームリーダーと故笹井芳樹グループディレクターらが、ES細胞から視細胞を含む立体網膜を誘導する培養法を開発し、これを移植治療に応用する研究の進展が期待されている。
理研CDBの白井博志研修生と万代道子副プロジェクトリーダー(網膜再生医療研究開発プロジェクト、高橋政代プロジェクトリーダー)らはサルの視細胞変性モデルを作成し、ヒトES細胞由来網膜組織を移植した結果、視細胞として生着・成熟することを明らかにした。この研究成果はPNAS Plusに12月22日付けでオンライン発表された。
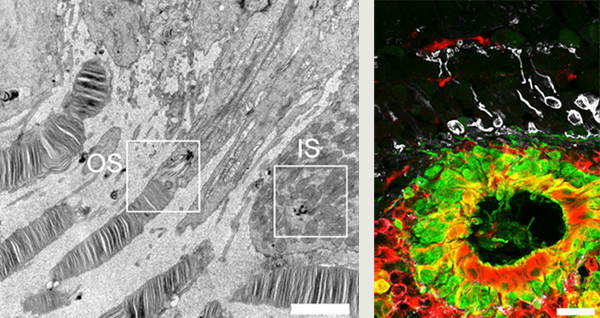
万代らは以前、マウスをモデルにした研究で、ES細胞やiPS細胞から誘導した網膜組織を網膜下に移植すると、長期にわたって生着、成熟することを明らかにしていた。そこで今回、今後の臨床応用に向けた研究を想定して、ヒトES細胞由来網膜組織を霊長類に移植して同様の検証を試みることにした。
霊長類であるサルへの移植を行なう前に、まずラットを用いて諸条件を検討した。分化誘導50〜150日目のヒトES細胞由来網膜前駆組織を免疫不全ラットの網膜下に移植したところ、視細胞は分化200日目以降に環状の構造をとって生着し、桿体視細胞マーカーであるロドプシンを発現していることが確認された。さらに、電子顕微鏡で詳しく調べると、分化293日目に視細胞の高度な成熟を示す外節構造も確認された。また、どの程度分化した網膜組織を移植するのが適切か検討した結果、分化誘導50〜60日目の比較的未成熟な網膜組織(この時点では明確な視細胞を含まない)を移植した場合に、より厚みのある視細胞組織が得られることが明らかになった。
霊長類では実用的な視細胞変性のモデルがないため、次に万代らはその開発を行なう必要があった。網膜色素変性では、一般的に網膜中心の周辺部から桿体視細胞の変性が進み、やがて症状が進むと網膜中心部の錐体幹細胞も変性する。そのため、最初は中心視力が維持されつつ視界の周辺部が見えにくくなり、やがて視野中心における視力の低下に至ることが多い。この病態を部分的にサルで再現するために、中心部の周辺において局所的に視細胞を欠失するモデルの開発を目指した。その結果、塩化コバルトの網膜下注射またはレーザー光照射のいずれかの方法で、この病態を再現できることがわかった。変性部位では、網膜の電気反応が消失したことも確認された。通常の眼科診療で用いる画像診断などの検査法で網膜の状態をモニタリングできることも確認した。
そこで、実際に分化60日目前後のヒトES細胞由来網膜前駆組織を免疫抑制下で視細胞変性サルに移植する実験を行なった。その結果、移植片はおおよそ分化120日目までは細胞増殖して成長したが、その後増殖が止まることが分かった。また、分化90日目に視細胞早期マーカーの発現、分化150日目以降で桿体・錐体視細胞マーカーの発現が見られ、ラットの場合と同様に、移植後に視細胞が分化、成熟していることが示された。さらに、頻度は低いものの、移植組織由来の視細胞がホスト網膜の双極細胞と神経接続していることを示唆する組織学的な結果も得られた。
今回の研究によってサルの視細胞変性モデルが確立し、実際の臨床応用に向けた移植条件や手術方法の検討が行なえるようになった。眼科医でもある万代副プロジェクトリーダーは、「今後、iPS細胞由来の網膜組織でも同様に生着するのか、また、生着した視細胞の機能についても詳細に検討していきたい」と語った。
| 掲載された論文 |
|---|