
CDBからのニュース、お知らせを掲載しています。
運動の制御を司る小脳の皮質は、複数種類の細胞が整然と並ぶ美しい層構造を形成している。深層から順に、顆粒層、プルキンエ細胞層、分子層から成る。中間層で情報処理の主力を担うプルキンエ細胞は、大きな細胞体と表層側に団扇のように広がる樹状突起、深層側に長く伸ばした軸索が特徴だ。一方、小型の顆粒細胞は全身体から送られてくる情報をプルキンエ細胞へと伝える役割を担う。小脳の発生は、これらの細胞が異なる2つの領域から生まれ、移動して層構造を形成するという非常にユニークな様式をとる。その発生の複雑さゆえ、他の脳神経系組織と比べ、小脳の発生過程を試験管の中に再現するのは困難とされていた。
理研CDBの六車恵子専門職研究員(器官発生研究チーム、竹市雅俊チームリーダー)、笹井芳樹元グループディレクターらは、ヒトES細胞から機能的な小脳神経細胞を生み出し、さらに、発生初期の胎児のものとよく似た層構造を有する小脳皮質を形成することに成功した。本成果は、科学誌Cell Reports電子版に1月30日付で掲載された。
研究チームはこれまで、胚発生の過程を試験管内で再現する「自己組織化」の原理を用いて様々な神経組織の立体構造の作製に成功してきた。2010年にはマウスES細胞を用いて小脳ニューロンの誘導に成功。「SFEBq法」(完全無血清培地を用い、浮遊凝集培養する)を用いて培養後、FGF2とインスリンを作用させて小脳ニューロンの誘導に必須である峡部オーガナイザー様の組織を誘導し、二次的に小脳を誘導するという手法を見出した(科学ニュース:2010.9.18)。加えて、BMP4を添加することで顆粒細胞の誘導にも成功したが、プルキンエ細胞と顆粒細胞を同時に発生させるには至らなかった。そこで六車らは、マウスES細胞で見出した手法をヒトES細胞に応用し、小脳神経細胞の作製を試みた。
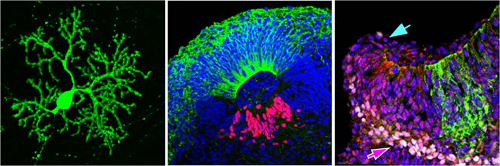
マウスES細胞の手法をヒトES細胞に試してみると、ヒト多能性幹細胞のアポトーシスを抑制するROCK阻害剤を添加しても、小脳への分化誘導培地の下では細胞凝集塊が非常に脆く、長期培養は困難だった。そこで様々な因子を検討し、TGF-β阻害剤を加えることで脆弱性を克服し、凝集塊を安定的に培養できることを見出した。ここにFGF2を作用させると、14~21日後には峡部オーガナイザー特異的なマーカー遺伝子の発現を示した。35日後には、塊内の大部分の細胞が分化初期のプルキンエ細胞マーカーのひとつであるKIRREL2を発現し、ドーナツ型に細胞が整列した管状構造を複数形成した。種々のマーカー遺伝子の発現パターンを調べると、小脳発生の初期に見られる神経上皮組織の特徴とよく似ていた。中でも、KIRREL2は膜タンパクであることから、この抗体を用いて細胞を選り分けることができる。FACS解析の結果、塊内の細胞の約30%がKIRREL2陽性のプルキンエ前駆細胞に変化していることわかった。
顆粒細胞は、プルキンエ細胞とのシナプス形成を介して、その成熟を促す働きがある。そこで、上記で得られた細胞塊を一度バラバラにし、マウス胎児から分離した顆粒細胞との共培養を行うと、さらに分化の進んだプルキンエ細胞様の神経細胞が得られた。プルキンエ細胞の形態的特徴を備えていることに加え、電気生理学的な特性もマウス生体由来のプルキンエ細胞と類似していた。これまでヒトのプルキンエ細胞は入手困難だったことから、この電気生理学的解析結果は今後、ヒトプルキンエ細胞の解析結果の1つのスタンダードとなり得る。
培養35日目の細胞塊に形成された管状構造を詳しく観察すると、多くは小さな丸型だが、中には比較的大きな楕円形を成すものがあることに気づいた。楕円形の管状構造は、興味深いことに、細胞塊の表層側と中心側とで遺伝子発現パターンが異なり、その様子は神経管の背側/腹側軸の極性が示すパターンと酷似していた。この楕円形の管状構造を高効率に作製できるシグナル分子を探索したところ、FGF19を見出した。また、マウスES細胞の場合と異なり、ヒトES細胞の35日目の細胞塊には非常に少量ながら顆粒細胞様の細胞も出現していた。しかし層状に並ぶことはなく、細胞塊全体に散在していた。これはSDF-1欠損マウスの小脳で見られる表現型とよく似ており、実際にSDF-1を培養28日目の細胞塊に添加したところ、顆粒細胞をプルキンエ細胞の表層側に整列させることに成功。顆粒細胞とプルキンエ細胞が層を成す小脳皮質の立体構造を試験管内に再現することができた。このとき、細胞塊の端にはくるりと丸まった構造が観察でき、顆粒細胞を生み出す「菱脳唇」によく似た遺伝子発現パターンを示すことが分かった。
研究チームは、今回得られた手法をヒトiPS細胞に用い、患者由来の疾患小脳モデルの作製にも取り組んでいる。このように人工的に作製した小脳組織を用いれば、疾患の原因となる分子メカニズムの究明や、薬剤のスクリーニングにも活用できると期待される。また、未だ多くの謎に包まれた小脳の発生機構を解明することもできるかもしれない。「小脳は発生時、非常にダイナミックに組織形態を変化させます。現在はまだ第1三半期(妊娠14週目くらいまで)相当という、発生のごく初期段階の小脳しか作製できませんが、今後さらに発生の進んだ小脳組織を試験管内に再現することができれば、このような劇的な形態変化を駆動する様々な機構を明らかにできるのではないかと考えています」と、六車研究員は笑顔で語った。
| 掲載された論文 | Self-Organization of Polarized Cerebellar Tissue in 3D Culture of Human Pluripotent Stem Cells |
|---|---|
| 関連記事 | ES細胞から小脳プルキンエ細胞の誘導に成功 |